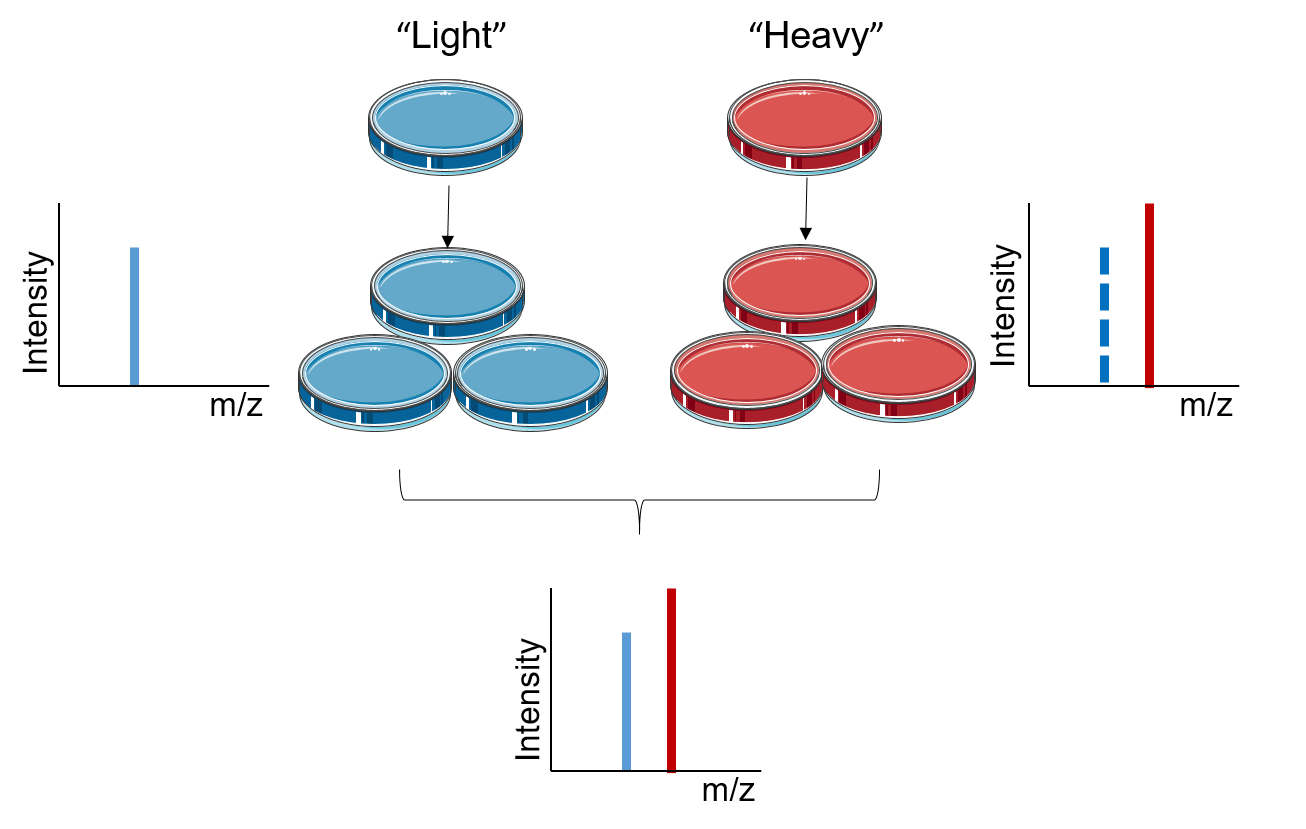
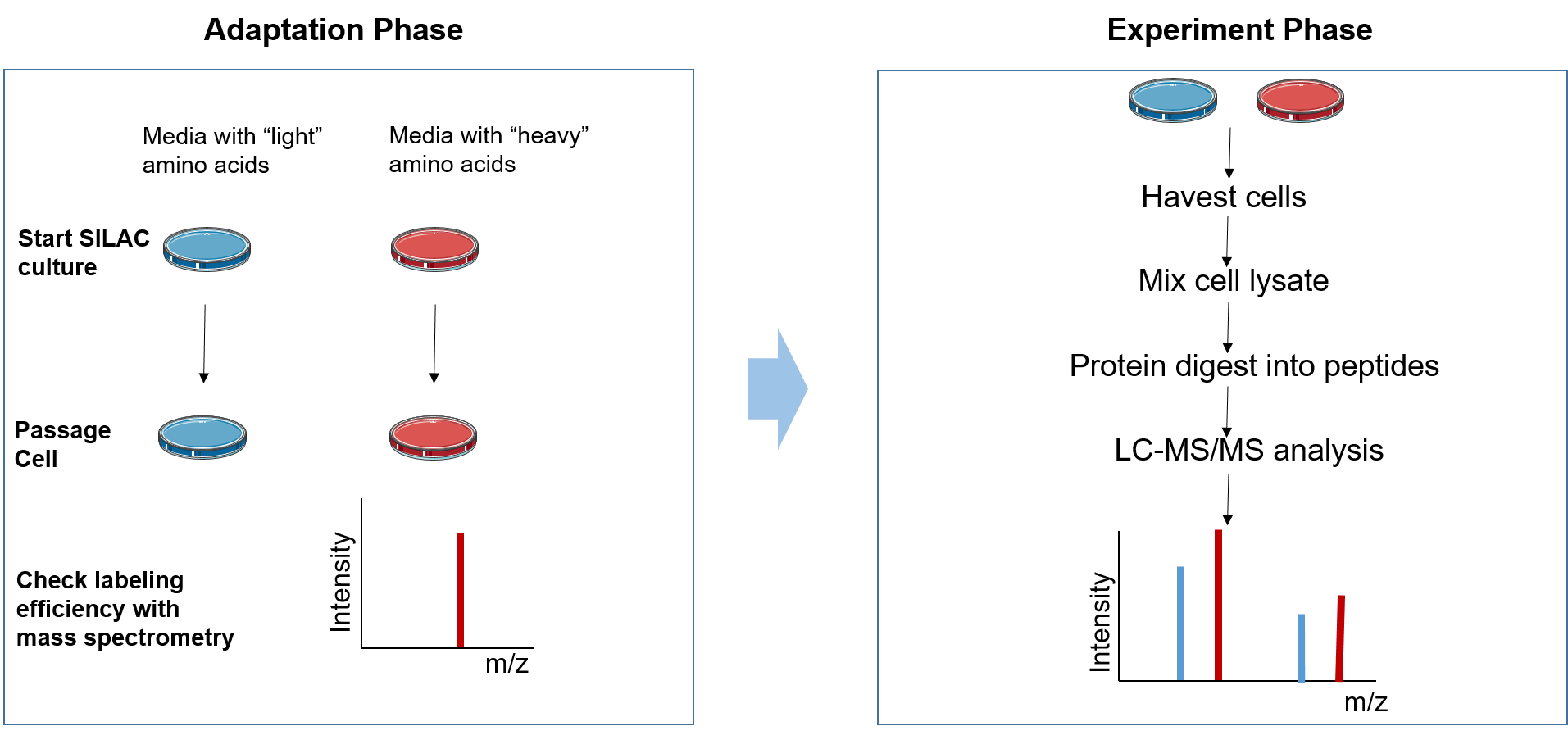
蛋白組/代謝組
蛋白/核酸相互作用
- RNA-蛋白/RNA互作
- RNA pull down

- circRNA pull down

- miRNA pull down

- RIP

- DNA-蛋白互作
- DNA pull down

- ChIP (染色質(zhì)免疫共沉淀)

- 化合物-蛋白互作
- 化合物pull down

IP / Pull down Beads
標簽抗體
分子互作試劑盒


 實驗熱線:4006991663
實驗熱線:4006991663