
背景:肝細胞癌(HCC)是全球第五大最流行的惡性腫瘤和第二大與癌癥相關的死亡原因��。它的發(fā)生歸因于代謝物相關基因調控改變引起的細胞代謝重編程�。有證據表明,糖代謝異常是癌癥的突出特征����,然而有關糖原調節(jié)的異常很少被研究。因此����,明確這種異常代謝的機制或許可以為肝細胞癌的治療提供新的靶點����。
內容概述:
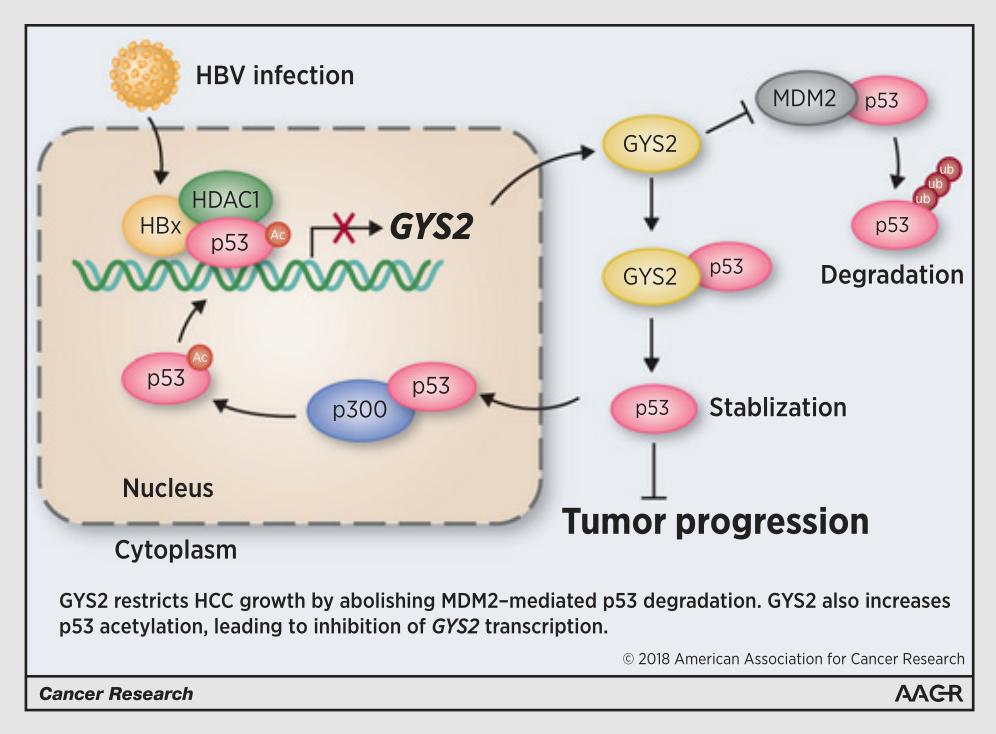
2019年2月���,輝駿生物合作伙伴���,中山大學腫瘤中心華南腫瘤學國家重點實驗室在期刊Cancer Research(IF2019=9.727)上發(fā)表題為“A GYS2/p53 Negative Feedback Loop Restricts Tumor Growth in HBV-Related Hepatocellular Carcinoma”的最新論文,證明了糖原合成酶2(GYS2)通過p53的負反饋調節(jié)環(huán)來限制乙肝病毒相關性肝癌的生長��。GYS2在HCC中的表達明顯下調��,并與糖原含量降低和不良患者預后相關�����。GYS2的低表達可通過調控p53來促進細胞體外增殖和體內腫瘤生長���。GYS2與MDM2競爭性結合���,阻止MDM2介導的p53泛素化和降解;GYS2還增強了p300誘導的p53蛋白K373/382位點的乙?���;?�,進而負反饋抑制了HBx/HDAC1復合物支持下的GYS2轉錄����。研究結果提示:GYS2在HCC中作為一個預后因子和腫瘤抑制因子發(fā)揮作用�,本研究中發(fā)現的HBx/GYS2/P53信號通路能夠調節(jié)糖原代謝,為肝癌的臨床治療提供了一個有前途的治療靶點����。
主要技術:
Co-IP、RNA seq����、ChIP�、GST pull-down、雙熒光素酶分析等����;
輝駿生物為本研究提供了GST pull down技術服務。
研究路線:

研究結果:
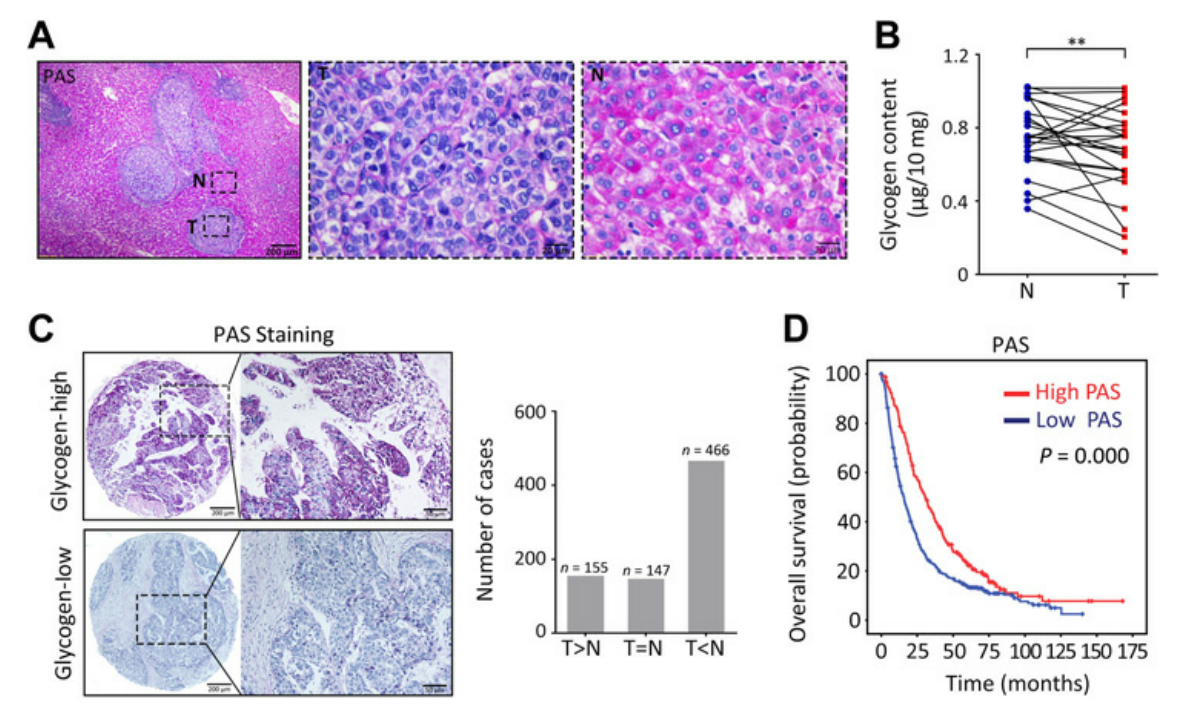
1. 肝細胞癌中糖原含量降低
研究者通過PAS染色分析發(fā)現肝癌組織中的糖原與非腫瘤組織相比明顯減少(圖1A)���。對768例HCC患者組成的樣本進行PAS染色����,根據陽性染色比例將患者分為高PAS組和低PAS組,Kaplan-Meier分析顯示低PAS染色與總體生存情況不良相關(圖1D)�,多變量Cox回歸模型進一步顯示糖原含量是HCC總生存率的獨立預后因素。這些數據表明���,肝細胞癌中糖原合成受到抑制����。
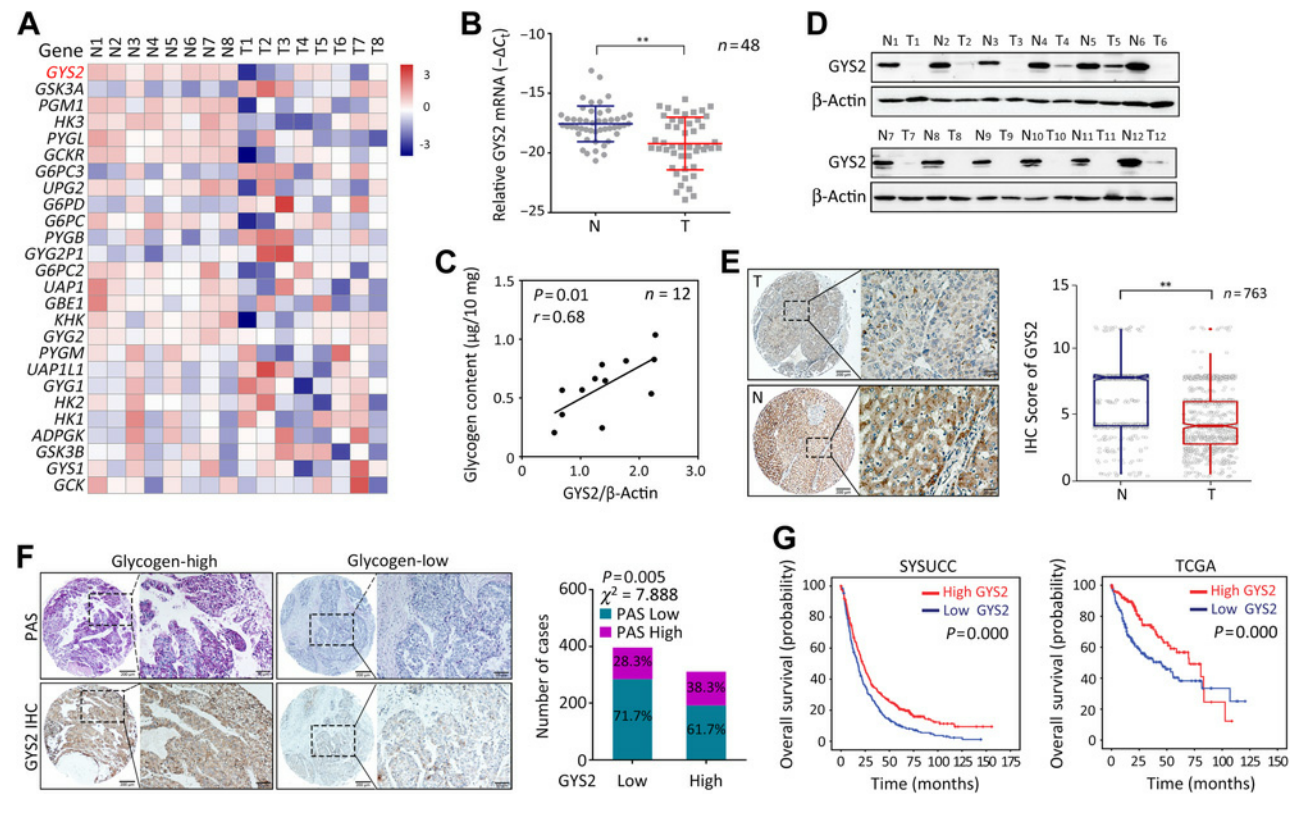
2. GYS2在肝細胞癌中下調�,并與不良患者預后相關
8對肝癌組織的RNA-seq轉錄譜顯示:涉及糖原合成和代謝很多基因下調,其中GYS2顯著下調(圖2A)�。之后分別對HCC細胞系、HCC新鮮腫瘤組織的mRNA和蛋白進行了檢測���,qPCR�、Western Blot��、免疫組化實驗均證實GYS2在HCC樣本中表達下調(圖2B-F)�����, PAS染色結果顯示GYS2表達與糖原含量呈正相關 (圖2F)�。Kaplan-Meier分析顯示���,GYS2缺乏的患者在SYSUCC和癌癥基因組圖譜中的總體存活率都不佳(圖2G)。多變量Cox回歸模型和分層生存分析進一步表明GYS2是影響HCC總生存率的獨立預后因素��。
3. GYS2缺失促進肝癌體內外增殖
為了探討GYS2在HCC中的生物學功能�����,研究者在HepG2和QGY-7703細胞中敲除GYS2�����,在Bel-7402和Bel-7404細胞中過表達GYS2(圖3A)��,并進行了一系列細胞功能實驗�����。MTT結果顯示GYS2沉默導致細胞增殖能力顯著增加���,而過表達導致細胞增殖能力下降(圖3B)。EdU實驗表明GYS2基因敲除可顯著誘導EDU陽性細胞�����,過表達使EDU陽性細胞減少(圖3C)。流式細胞周期檢測顯示沉默GYS2的細胞阻滯于S-G2-M期�����,過表達GYS2導致更多細胞處于G0-G1期(圖3D)���。此外���,克隆形成實驗表明GYS2缺失促進HCC細胞增殖,過表達則削弱細胞增殖(圖3E)�����。為了在體內驗證這些效應����,研究者建立了裸鼠皮下注射細胞的異種移植模型。與對照組相比�����,GYS2沉默的荷瘤細胞生長更快��,糖原含量更少,Ki-67表達更高(圖3F)����。這些發(fā)現表明,缺乏GYS2極大地促進了肝癌細胞的生長�。

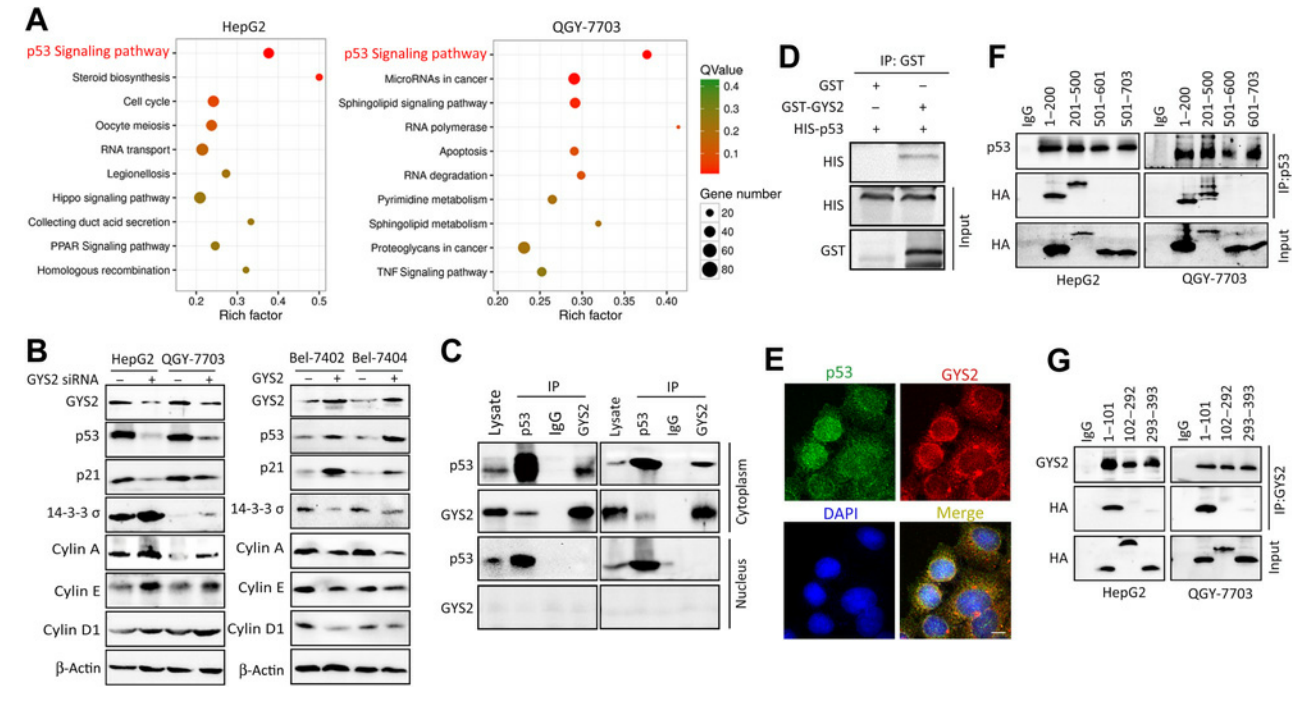
4. GYS2激活p53信號通路
為了揭示GYS2介導肝癌增殖的潛在機制,研究者在敲除GYS2的HepG2和QGY-7703細胞中進行了RNA seq分析�,發(fā)現p53通路都受到了明顯抑制(圖4A);之后在過表達/干擾GYS2的細胞中分別檢測了p53及其靶蛋白的含量�����,發(fā)現GYS2過表達促進p53蛋白水平升高����,進而調控了p53的靶基因,如p21���,14-3-3S和cyclin D1(圖4B)����。接下來研究者通過Co-IP實驗研究了這兩個蛋白之間的相互作用(圖4C)��,又通過GST pull-down實驗證實了GYS2與p53直接結合(圖4D和E)��,并進一步發(fā)現p53的1-101aa區(qū)和GYS2的1-500aa區(qū)是兩者結合所必需的(圖4F和G)����。為了驗證GYS2是否通過p53發(fā)揮抗肝癌作用,研究者進行了功能回復實驗�。恢復p53表達可部分減弱GYS2缺失對HepG2和QGY-7703細胞生長的促進作用����。這些數據表明,GYS2在肝癌細胞中通過與p53的相互作用發(fā)揮腫瘤抑制作用�。
5. GYS2通過與MDM2的競爭性相互作用穩(wěn)定p53
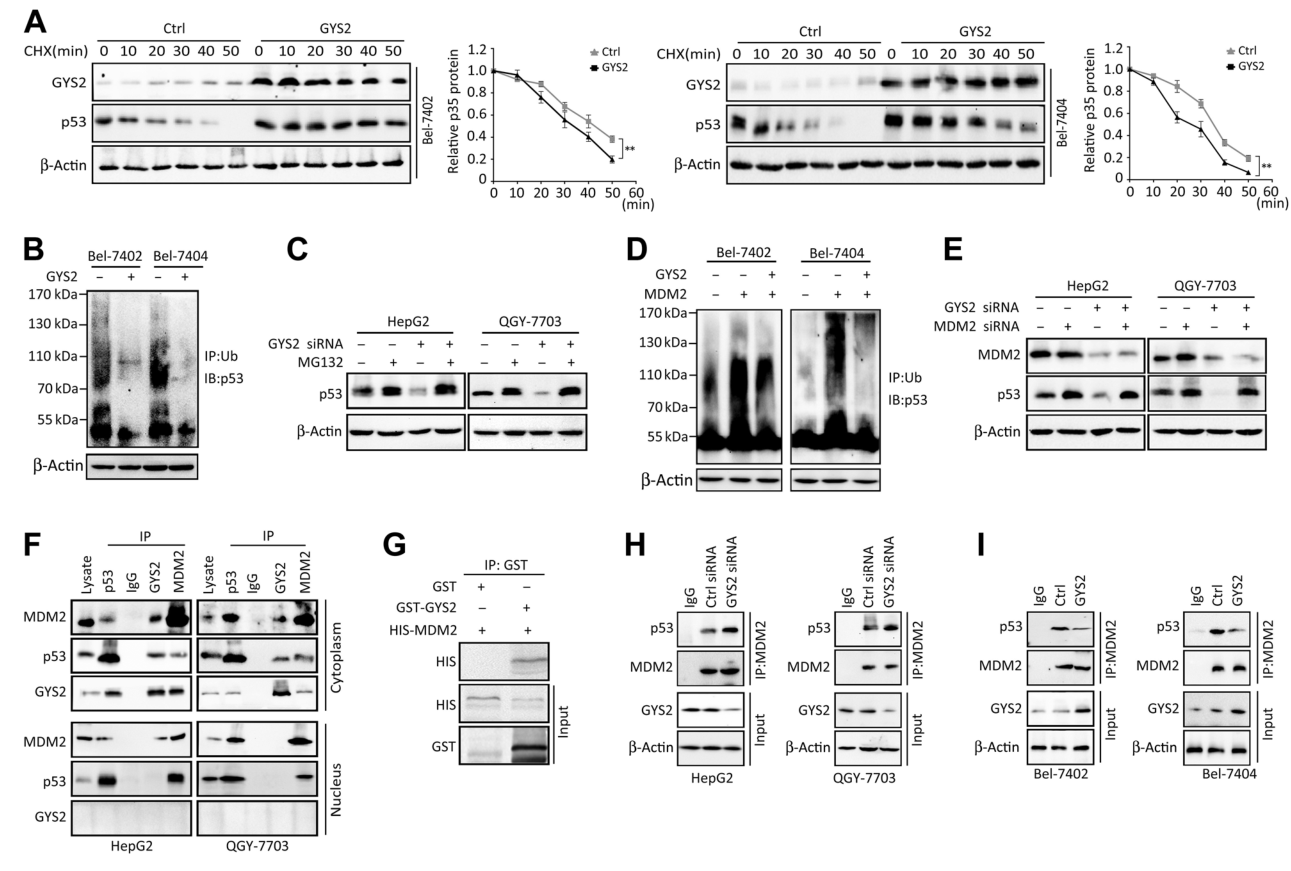
為探索GYS2上調p53的機制,使用放線菌酮CHX(翻譯抑制劑)處理細胞����,發(fā)現GYS2過表達顯著延緩了p53蛋白的降解(圖5A)。使用MG-132(蛋白酶體抑制劑)預處理GYS2過表達細胞�����,p53泛素化的IP-WB結果顯示其泛素化水平減弱 (圖5B)�,此外,MG-132的預處理可抵消si-GYS2對p53蛋白水平的抑制 (圖5C)�。
由于E3泛素連接酶MDM2對p53泛素化起關鍵調控作用,他們接著探索了MDM2是否參與GYS2對p53的作用��。p53泛素化的IP-WB結果表明,GYS2過表達減弱了MDM2過表達引起的p53泛素化增加���,而si-GYS2阻斷了si-MDM2對p53泛素化的抑制(圖5D)����。si-MDM2和si-GYS2共處理細胞時�,WB結果顯示對si-MDM2顯著抑制了si-GYS2對p53蛋白的下調 (圖5E)。
接下來����,研究者通過Co-IP實驗發(fā)現GYS2、p53和MDM2相互結合形成了蛋白質復合物(圖5F)�����。GST pull-down實驗也證實了GYS2與MDM2的直接結合(圖5G)�。此外,MDM2和p53之間的相互作用因GYS2的下調而增強�����,因GYS2的過表達而減弱(圖5H和I)�����。這些數據表明,GYS2競爭性結合MDM2來抑制p53泛素化�����,從而穩(wěn)定p53蛋白�。
6. P53通過依賴p300的負反饋環(huán)抑制GYS2
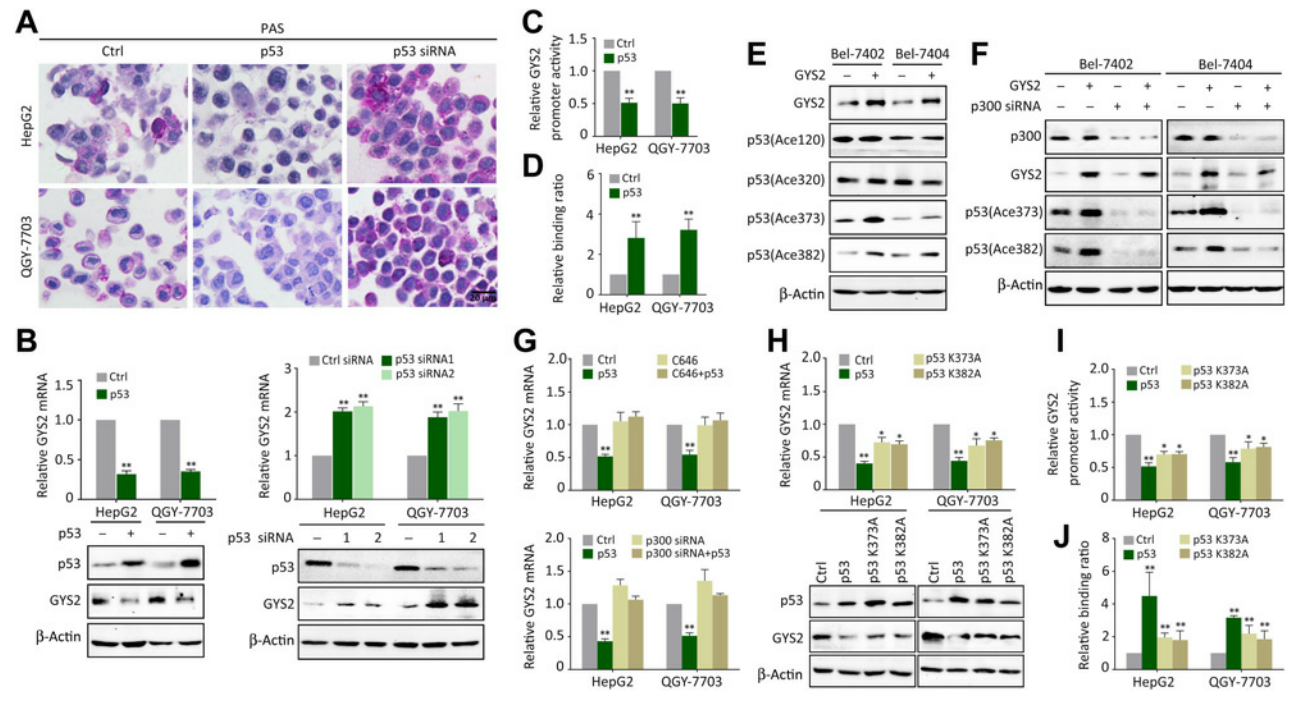
鑒于GYS2在p53介導的異常糖原代謝中有作用����,作者又在p53過表達/干擾情況下檢測了GYS2的表達,發(fā)現si-p53上調了GYS2的mRNA和蛋白水平(圖6B)��;雙熒光素酶報告基因檢測發(fā)現p53蛋白降低了GYS2啟動子的活性(圖6C)���;ChIP實驗也證實了p53蛋白與GYS2啟動子的結合(圖6D)����。以上結果表明p53可以負反饋調節(jié)GYS2����。
p53的轉錄后修飾是其功能所必需的,例如p300可介導p53蛋白K373/382處的乙?�;?����,增強其結合靶DNA的能力,因此研究了p300是否影響p53對GYS2的調控�。作者發(fā)現過表達GYS2增加了p53在K373和 K382位點的乙酰化 (圖6E)�����,但當敲除p300后����,這一作用消失(圖6F)。用特異性p300抑制劑C646或si-p300處理細胞�,可以消除p53介導的GYS2水平下降(圖6G)。構建不能被p300乙?;?個p53突變體(p53-K373A和 p53-K382A)并分別轉染細胞,發(fā)現GYS2 mRNA和蛋白的減少較少(圖6H)�,此外,在表達p53-K373A或p53-K382A的細胞中�,p53對GYS2啟動子的抑制作用和結合減弱(圖6I和J)。這些結果表明�,在負反饋環(huán)中,p53通過p300介導的乙?;谵D錄水平上抑制GYS2。
7. HBx-HDAC1復合物促進p53介導的GYS2抑制作用
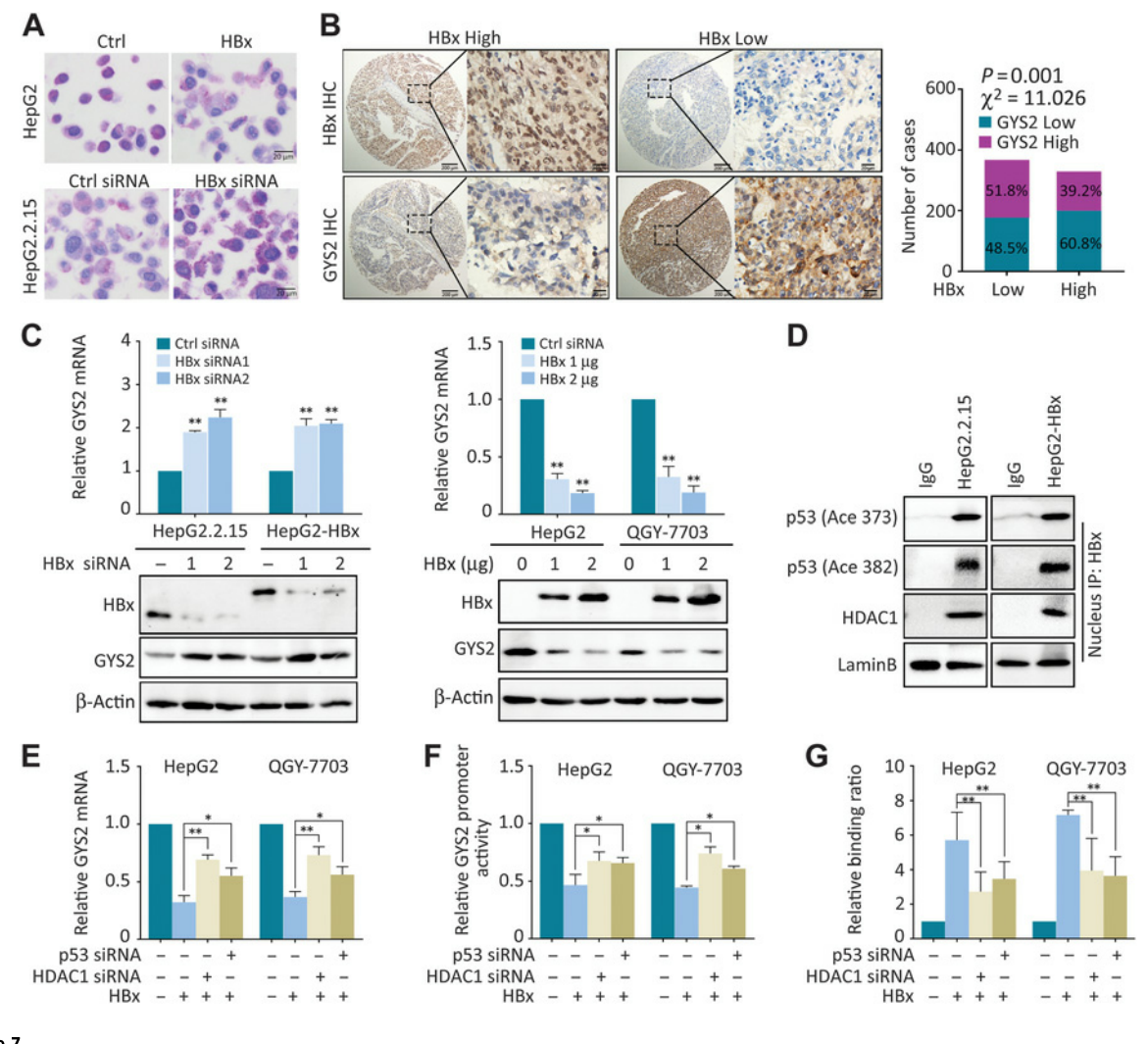
HBV編碼的關鍵致癌蛋白HBx在糖原代謝中的作用尚不明確��。分別在肝癌細胞中過表達或敲除HBx,PAS染色結果顯示HBx過表達減少了HCC細胞中的糖原含量��,而HBx敲除恢復了這一趨勢(圖7A)����。在HBx陽性的病例中����,GYS2的低表達和PAS染色更常見(圖7B),而在HBx陰性的肝癌細胞中����,過表達HBx下調了GYS2的表達(圖7C)。據報道��,HBx需要招募協同因子來發(fā)揮活性抑制作用���,而組蛋白去乙?����;?HDAC)是與HBx相互作用的主要基因抑制因子�。研究者用HDAC家族蛋白的siRNA處理肝癌細胞��,發(fā)現只有當HDAC1 被敲除時,GYS2表達上調�����。Co-IP實驗也顯示了HBx�、HDAC1和細胞核內乙酰化的p53之間的相互作用(圖7D)�����。在HBx過表達的細胞中�����,HDAC1或p53的敲除部分減弱了GYS2 mRNA的損失 (圖7E)��。熒光素酶和ChIP實驗也表明���,HDAC1或p53的敲除降低了HBx與GYS2啟動子的結合(圖7F和G)��。這些數據表明�����,HBx與HDAC1共同促進了HBV陽性肝癌中p53對GYS2表達的抑制�����。
結論:
本研究首次報道了HCC組織中糖原含量顯著降低���,并與不利的患者預后相關�����,這歸因于新鑒定的HBx/GYS2/p53信號軸。GYS2沉默通過靶向p53信號通路促進HCC細胞增殖而非遷移�,并提供了兩條獨立的證據線來支持GYS2和p53之間的關系。一方面����,確定p53是GYS2的下游靶點,GYS2在細胞質中與p53相互作用��,與MDM2競爭以穩(wěn)定p53免于蛋白酶體降解����;另一方面,p53以負反饋方式抑制GYS2表達和糖原含量��。這些數據表明p53和GYS2可能通過平衡彼此的表達而在HCC中發(fā)揮功能�。









 實驗熱線:4006991663
實驗熱線:4006991663












